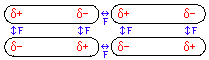Zwischenmolekulare Kräfte
1. Fakten
a) Übergang zwischen den Aggregatszuständen
Gegeben sei ein beliebiger Stoff, der bei einer bestimmten Temperatur im festen Zustand vorliegt. Dieser Stoff wird in einem offenen Gefäß langsam erwärmt, so dass sich die folgenden Änderungen ergeben:
| Aggregatszustand | fest | flüssig | gasförmig | |
| zugeführte Energie | |||
| Temperatur | |||
| Dichte | |||
| Folgerungen für die Teilchenebene |
| Bewegungsenergie (Geschwindigkeit) der Teilchen | ||
| mittlerer Teilchen- abstand | |||
| Folgerung : | Zwischen den Teilchen eines Stoffes wirken Anziehungskräfte. Zur Überwindung dieser Anziehungskräfte muss dem Stoff und damit den Teilchen Energie zugeführt werden. Die Folge ist die eine Zunahme der Bewegungsenergie der Teilchen und damit eine Zunahme des mittleren Teilchenabstandes. |
b) Vergleich der Siedetemperaturen verschiedener Stoffe
| Stoff | Siedetemperatur | aufgebaut aus: |
| NaCl | +1465°C | Ionen |
| Cl2 | -34°C | unpolare Moleküle |
| Br2 | +59°C | unpolare Moleküle |
| I2 | +186°C | unpolare Moleküle |
| HF | +20°C | polare Moleküle |
| HCl | -85°C | polare Moleküle |
| HBr | -67°C | polare Moleküle |
| HI | -35°C | unpolare Moleküle |
2. Van-der-Waals-Kräfte
1873 von Johannes van der Waals postuliert (niederländischer Physiker) und
1930 von Fritz London erklärt (deutsch-amerikanischer Physiker)
Die Antreffwahrscheinlichkeit der Elektronen in einem Molekül oder Atom ist nicht konstant, sondern ändert sich ständig. Dadurch kommt es zu lokalen Schwankungen der Ladungsdichte in der Elektronenhülle. Die Folge ist, dass selbst ungeladene Moleküle und Atome temporäre Dipole sind.
Nachbaratome bzw. Nachbarmoleküle sind ebenfalls temporäre Dipole. Wenn diese temporären Dipole nahe beieinander sind, so richten sie sich aufeinander aus, d.h. die positive Teilladung des einen Teilchens befindet sich möglichst nahe an der negativen Teilladung des anderen Teilchens. Dadurch ist die potentielle Energie des Systems am geringsten. Die Folge der Ausrichtung ist eine Anziehungskraft zwischen den Molekülen oder Atomen: Van-der-Waals-Kraft
Die Van-der-Waals-Kräfte hängen von der Polarisierbarkeit der Teilchen ( = Leichtigkeit mit der Ladungsverschiebungen in einem Teilchen auftreten) ab. Die Polarisierbarkeit ist um so größer, je größer die Teilchenoberfläche ist.
| Zusammenfassung: | Van-der-Waals-Kräfte sind Anziehungskräfte, die zwischen nicht verbundenen Atomen oder Molekülen wirken. Sie sind um so größer, je größer die Teilchenoberfläche ist. Die Reichweite der Van-der-Waals-Kräfte ist gering. Beachte: Van-der-Waals-Kräfte wirken sowohl zwischen Atomen und unpolaren Molekülen wie auch zwischen polaren Molekülen. Allerdings treten zwischen polaren Molekülen zusätzliche Anziehungskräfte auf. |
3. Dipol-Dipol-Kräfte
Ein Fluor-Molekül und ein Hydrogenchloridmolekül besitzen etwa die gleiche Moleküloberfläche ⇒ gleich große Van-der-Waals-Kräfte: Zu erwarten sind deshalb gleiche Siedetemperaturen für die Stoffe Fluor und Hydrogenchlorid. Die Messung der Siedetemperaturen zeigt jedoch, dass Hydrogenchlorid erst bei einer viel höher Temperatur siedet.
| Stoff | Siedetemperatur |
| Fluor | -188°C |
| Hydrogenchlorid | – 85°C |
| Folgerung: | Zwischen den Hydrogenchloridmolekülen wirken zusätzliche Kräfte, die die höhere Siedetemperatur verursachen. |
| Erklärung: | Hydrogenchloridmoleküle sind permanente Dipolmoleküle, da die an der Atombindung beteiligten Atome sich in ihrer Elektronegativität unterscheiden. So ist das Chloratom elektronegativer (EN = 2,8) als das Wasserstoffatom (EN = 2,2); die Folge ist eine unsymmetrische Verteilung des bindenden Elektronenpaares (polare Atombindung) und in diesem Fall auch ein polares Molekül.
Die energetisch günstige Anordnung von Dipolmolekülen zeigt die folgende Grafik:
Zwischen den permanenten Dipolen herrschen neben den Van-der-Waals-Kräften zusätzliche Dipol-Dipol-Kräfte (F), die die Ursache der höheren Siedetemperatur sind.
|
| Zusammenfassung: | Dipol-Dipol-Kräfte sind Anziehungskräfte zwischen polaren Molekülen (permanenten Dipolen). Sie sind um so größer, je polarer die Moleküle gebaut sind. Dipol-Dipol-Kräfte wirken bei polaren Molekülen zusätzlich zu den immer vorhandenen Van-der-Waals-Kräften. |
4. Beispiele zu den Van-der-Waals-Kräften und Dipol-Dipol-Kräften
| Stoff | Siedetemperatur | aufgebaut aus: |  |
| Cl2 | -34°C | unpolaren Molekülen | |
| Br2 | +59°C | unpolaren Molekülen | |
| I2 | +186°C | unpolaren Molekülen |
| Stoff | Siede- | aufgebaut aus: |  | Elektronegativitäts- unterschied: |
| HCl | -85°C | polaren Molekülen | 0,6 | |
| HBr | -67°C | polaren Molekülen | 0,5 | |
| HI | -35°C | unpolaren Molekülen | 0 | |
| Im Gegensatz zum HI-Molekül sind die HBr- und HCl-Moleküle permanente Dipolmoleküle, d.h. es wirken zwischen den HBr-Molekülen und zwischen den HCl-Molekülen zusätzlich Dipol-Dipol-Kräfte. Wie der Verlauf der Siedetemperaturen zeigt, überwiegen in diesem Beispiel die Van-der-Waals-Kräfte. | ||||
| HF | +19°C | polaren Molekülen | ? | 1,9 |
5. Wasserstoffbrückenbindungen
a) Hydrogenfluorid besitzt eine unerwartet hohe Siedetemperatur.
| Stoff | Siedetemperatur | aufgebaut aus: | Elektronegativitäts- unterschied: |
| HF | +19°C | polaren Molekülen | 1,9 |
| HCl | -85°C | polaren Molekülen | 0,6 |
| HBr | -67°C | polaren Molekülen | 0,5 |
| HI | -35°C | unpolaren Molekülen | 0 |
Diese abnorm hohe Siedetemperatur ist die Folge von Wasserstoffbrückenbindungen, die sich zwischen dem H-Atom eines HF-Moleküls und dem F-Atom eines anderen HF-Moleküls ausbildet:
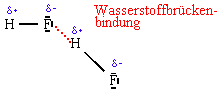
Wasserstoffbrückenbindungen sind zwischenmolekulare Kräfte, die zusätzlich zu den Van-der-Waals-Kräften auftreten. Ihre Ursache ist eine elektrostaische Wechselwirkung zwischen einem positiv polarisierten Wasserstoffatom und 2 stark elektronegativen weiteren Atomen (N, F oder O-Atome).
Die Ausbildung von Wasserstoffbrückenbindungen erfolgt zwischen Molekülen, bei denen entweder
|